El día 6 de mayo la FDA ha aprobado iloperidona (Fanapta®, Zomaril®), un nuevo medicamento oral para la esquizofrenia, pertenece al grupo químico de los benzisoxazoles como risperidona y paliperidona.(1). Está previsto lanzar en un futuro próximo la forma inyectable de depósito (2).
Aunque se postula como un antagonista mixto de los receptores D2/5HT2A, muestra una elevada afinidad sobre los receptores de norepinefrina alfa-1, de dopamina D3, y de serotonina 5HT2A. Afinidad intermedia por los receptores de norepinefrina alfa-2C, de dopamina D2A y D4, y de serotonina 5HT1A, 5HT1B, 5HT2C y 5HT6. La afinidad por otros receptores como los de norepinefrina alfa-2A, alfa-2B, beta1, beta2, de acetilcolina muscarínicos M1-M5, de histamina H1, de dopamina D1 y D5, colecistokinina A y B, de serotonina 5HTT7, y sobre los transportadores de dopamina y norepinefrina es baja. (3). Este perfil de afinidad a receptores permiten clasificar a iloperidona como un antipsicótico atípico, y se ha propuesto que el antagonismo sobre los receptores de noradrenalina alfa-2C puede contribuyen a mejorar la función cognitiva deteriorada en la esquizofrenia. (4). En los ensayos clínicos de fase II ha mostrado ser efectivo a dosis de 8 mg/día y presentar una buena tolerabilidad hasta dosis de 32 mg/día. Se recomienda emplear dosis de 12 a 24 mg/día en dos tomas. (5)
Iloperidona se absorbe bien cuando se administra por vía oral a sujetos en ayunas, El pico de concentraciones plasmáticas se produce al cabo de 2-4 horas tras la administración oral. La vida media de eliminación de iloperidona es, t1/2:18-33 h, lo que da lugar a que se precisen de 3-6 días de administración repetida, para obtener concentraciones en equilibrio estacionario. La coadministración con alimentos, enlentece la velocidad absorción, disminuye Cpmax y demora Tmax, pero no modifica la cantidad absorbida (AUC). Los efectos adversos más usuales con iloperidona son hipotensión ortostática, vértigo y somnolencia, parecen estar relacionados con los picos de dosis y la administración del fármaco con alimentos reduce su incidencia y gravedad. (6). Se metaboliza extensamente a través de los isoenzimas CYP2D6 y CYP3A4, generando dos metabólitos principales: P88 y P95, cuyas Cmax aparecen respectivamente a las 2 y 6h de la administración del producto padre, tienen respectivamente vidas medias de eliminación entre 26-37 y 23-31 h. Iloperidona y sus metabolitos tienen una elevada fijación a proteínas plasmáticas (95%). El metabolito P95 es incapaz de cruzar la barrera hematoencefálica, y por tanto no contribuye al efecto terapéutico. El segundo presenta un perfil de afinidad a receptores similar al de iloperidona. (7). Aproximadamente la mitad de la dosis administrada oralmente es eliminada por orina, mientras que 1/5 parte es recuperada en heces.
En abril del 2008, la revista Journal of Clinical Psychopharmacology dedicó un suplemento completo a los ensayos clínicos de iloperidona.
El primer artículo (8) se informa de forma sumaria de los resultados de eficacia obtenidos en 3 ensayos (estudios 1, 2 y 3) similares de fase III, randomizados, a doble ciego, para comparación de diversas dosis, controlados con placebo y con fármaco activo, de 6 semanas duración, 1 de titulación de dosis y 5 de mantenimiento. Los pacientes debían tener entre 18 y 65 años, y encontrarse en fase de exacerbación aguda o subaguda y una puntuación en la escala de síntomas positivos y negativos de la esquizofrenia (PANSS) ≥ 60 al inicio del ensayo. Se excluyeron los pacientes que necesitaron de forma continua otros fármacos psicotrópicos, incluyendo antidepresivos y estabilizadores del humor, pacientes tratados con clozapina en los 60 días antes del ensayo, o los que no hubieran mejorado suficientemente con tratamiento antipsicótico en los últimos 2 años. Durante el ensayo se permitió el uso de fármacos anticolonérgicos, lorazepam, zolpiden o hidrato de cloral. El análisis de la eficacia se realizó por intención de tratar (ITT), que incorpora a todos los pacientes que recibieron al menos una dosis de medicamento y que posteriormente fueron evaluados con la PANSS al menos 1 vez. Se emplearon los datos de obtenidos en la última visita del paciente o método de la última observación arrastrada hacia delante (LOCF). Se realizó un análisis de la covarianza, ajustado por centro de investigación, a dos colas considerando significativas p≤0,005.
En el estudio 1, los pacientes fueron randomizados en proporción 1:1:1:1:1, para recibir iloperidona a dosis de 4, 8, ó 12 mg/día, haloperidol 15 mg/día o placebo; se incorporaron respectivamente 121, 125, 124, 124 y 127 pacientes, se evaluaron 113, 114, 115,114 y 117. La variable principal de eficacia fue el cambio en la puntuación PANSS del inicio al final del ensayo. Solo la dosis más alta de iloperidona y haloperidol se mostraron superiores a placebo de forma estadísticamente significativa. La diferencia en el cambio en la PANSS entre el grupo de iloperidona 12 mg/día y placebo fue de 5,3 puntos (p=0,047), mientras que esta diferencia entre haloperidol y placebo fue 9,3 puntos (p<0 n="36);" p="0,010),"> 60, no debían haber padecido reciente otra patología médica ni comorbilidad psiquiátrica. La randomización se hizo en proporción 3:1 para recibir iloperidona (4-8 mg/día) o haloperidol (5 a 20 mg/día). Las dosis se ajustaron hasta la 4º semana, y luego se mantuvieron estables hasta la 6º semana. Los pacientes que completaron este periodo inicial de 6º semana a doble ciego fueron elegibles para continuar durante un periodo de mantenimiento 48 semanas, también a doble ciego. Se definió respuesta al tratamiento como una reducción de la PANSS≥20% desde el valor basal a la semana 4º o 6º. La principal variable de eficacia fue el tiempo hasta recaída durante el periodo de seguimiento a largo plazo. Se definió recaída como un incremento de la PANSS (empeoramiento) ≥ 25% respeto el inicio de la fase de seguimiento a largo plazo., o un incremento ≥10 puntos, o la interrupción del tratamiento por falta de eficacia, o agravamiento de la psicosis que conlleve a hospitalización, o in incremento ≥2 puntos en la CGI-C después de la 6º semana.
En la fase inicial de 6 semanas se incluyeron 1239 pacientes en el grupo con iloperidona y 405 al de haloperidol. Completaron esta fase el 1014 (81,8%) del grupo iloperidona y 312 (77,0%) del de haloperidol. De estos, 371 (36,6%) en el grupo iloperidona y 118 (37,8%) del grupo haloperidol, exhibieron respuesta al tratamiento y fueron elegibles para entrar en la fase de seguimiento a largo plazo. De estos 350 del grupo iloperidona y 114 del grupo haloperidol recibieron al menos una evaluación durante la fase de seguimiento. Durante la fase de seguimiento a largo plazo, el 36,4% de los pacientes de cada grupo de tratamiento interrumpió la medicación antes de finalizar el ensayo.
Al finalizarla fase de 6 semanas, la dosis media de iloperidona y haloperidol fueron 11,8 mg/día y 13,2 mg/día respectivamente. Al finalizar la fase de seguimiento a largo plazo las dosis medias de ambos fármacos fue igual, 12,5 mg/día.
Las tasas de recaídas fueron del 43,5% para iloperidona y 41,2% para haloperidol, riesgo relativo 1.030 (95%CI:0,743-1,428; p=0,8596). El tiempo medio hasta recaída fue de 89,8 días para iloperidona (mediana 50,0 días) y 101,8 días (mediana 78.0 días) para haloperidol (p=0,8411).
El cambio en la PANSS desde la evaluación basal a la última evaluación realizada (arrastrada hacia delante), fue de -16,1 puntos para iloperidona y -17,4 para haloperidol. Al final de estudio el 65% del grupo iloperidona y 66% del grupo haloperidol exhibieron mejoría con la CGI-C.
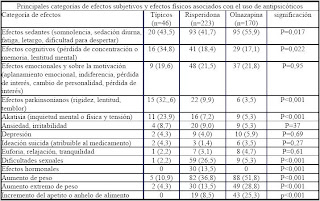
Durante la fase de 6 semanas de duración, el 68,6% de los 1231 sujetos que recibieron iloperidona presentaron al menos 1 efecto adversos, frente al 79,9% de los 403 del grupo que recibió haloperidol. La frecuencia de abandonos por acontecimientos adversos fue del 6,7% en el grupo iloperidona y del 9,4% del grupo con haloperidol. Fueron graves el 7,6% y el 7,7% en el grupo iloperidona y el de haloperidol respectivamente.
Durante la fase de seguimiento a largo plazo, presentaron al menos 1 efecto adverso, el 73,3% de los 371 pacientes del grupo iloperidona y del 68,6% de los 118 pacientes en el grupo haloperidol. Fueron serios en el 18,1% de los sujetos del grupo iloperidona y en el 16,1% del grupo haloperidol. Causaron la salida del estudio en el 4,3% del grupo iloperidona y en el 8,,5% en el grupo haloperidol.
Del total de pacientes que participaron en el estudio, 224 (18,2%) del grupo iloperidona y 56 (13,9%) del grupo haloperidol precisaron hospitalización durante el estudio. Se produjeron en este periodo 4 muertes, 3 en el grupo iloperidona y 1 en el grupo haloperidol.
Al final de estudio, el 48,2% de los pacientes con el grupo iloperidona y el 34,7% de los tratados con haloperidol habían mejorado, pero el 13,5% recibiendo iloperidona y el 36,4% de los recibiendo haloperidol, habían empeorado de su sintomatología extrapiramidal (p<0>0,001).
Durante las primeras 6 semanas, en el grupo iloperidona se ganó un promedio de 2,6 kg, frente a 0,6 kg en el grupo haloperidol. De los 222 pacientes que finalizaron las 52 semanas, la ganancia media de peso fue de 4,8 kg, mientras que en los 70 que finalizaron el el grupo haloperidol fue de 3,0 kg. Iloperidona mostró un perfil sobre los lípidos séricos menos desfavorable que haloperidol, pero más desfavorable sobre la glucemia.
La prolongación promedia del intervalo QTc al final de estudio fue de 10,3 mseg en el grupo iloperidona y de 9,4 mseg en el grupo haloperidol.
Comentarios finales
Las publicaciones que informan de iloperidona son borrosas, mezclan resultados de distintos ensayos clínicos, como si fueran un megaensayo,. y no lo es. Lo más correcto sería presentar por separado los resultados de los distintos ensayos.
Los ensayos de dosis múltiples de iloperidona sirven para detectar la dosis óptima, pero no para comparar con placebo o con fármaco activo. En estos ensayos los controles sirven para identificar un marco de referencia de las respuestas esperables.
Los datos de los estudios dan un perfil de seguridad muy favorable respecto a los controles activos, pero las dosis empleadas son comparativamente más bajas con iloperidona que con haloperidol o risperidona.
En algunos de los estudios se omiten las mediciones de la prolactinemia, lo que puede estar falseando los resultados.
En el estudio de seguimiento, el porcentaje de pacientes que pueden iniciar la fase de seguimiento a largo plazo es baja, pero aún más baja es la proporción de pacientes que acaban la fase de seguimiento.
La dosis recomendada de inicio de iloperidona es de 1 mg, 2 veces al día, con incrementos de 1 mg en cada toma, hasta una dosis de 6 a 12 mg dos veces al día (12-24 mg/día). Las dosis deben reducirse la mitad en pacientes que reciben inhibidores potentes de los CYP2D6 y CYP3A4, así mismo se debe actuar con precaución cuando se coadministre junto a otros medicamentos que se sepa que también prolonguen el intervalo QTc. Hay que tener en cuenta que, aunque no está recomendada, la polifarmacia antipsicótica es frecuente en psiquiatría.
Iloperidona parece un antipsicótico más, a ubicar entre risperidona, paliperidona y ziprasidona, con los que comparte estructura química y perfil de seguridad. No parece aportar nada nuevo al tratamiento de la esquizofrenia.
La esquizofrenia es un trastorno crónico, que afecta a las personas en las épocas tempranas de su vida adulta, y conlleva una carga tremenda de sufrimiento, discapacidad y disfuncionalidad en las personas que la padecen y sus familias. Las necesidades de las personas con esquizofenia son enormes, y generalmente insatisfechas, lo último que las personas con esquizofrenia necesitan son nuevos medicamentos que no aportan nada nuevo frente a los previamente existentes. Es más, estos nuevos medicamentos sustraen recursos que deberían ser invertidos en otras áreas verdaderamente carenciales, como recursos para una vida independiente, pisos protegidos, programas de inserción laboral, detección precoz de pródromos y apoyo domiciliario en las crisis y un largo etcétera. ,
________________________________________________________________________________
Bibliografía
(1) FDA Approvals: Fanapt.
http://cme.medscape.com/viewarticle/702793 (acceso del 27-05-2009).
(2)
Kelleher JP,
Centorrino F,
Albert MJ,
Baldessarini RJ Advances in atypical antipsychotics for the treatment of schizophrenia: new formulations and new agents.
CNS Drugs. 2002;16:249-61.
(3)
Kalkman HO,
Subramanian N,
Hoyer D. Extended radioligand binding profile of iloperidone: a broad spectrum dopamine/serotonin/norepinephrine receptor antagonist for the management of psychotic disorders.
Neuropsychopharmacology. 2001; 25:904-14.
(4)
Kalkman HO,
Loetscher E. alpha2C-Adrenoceptor blockade by clozapine and other antipsychotic drugs.
Eur J Pharmacol. 2003; 462:33-40.
(5)
Jain KK. An assessment of iloperidone for the treatment of schizophrenia.
Expert Opin Investig Drugs. 2000; 9:2935-43
(6)
Sainati SM,
Hubbard JW,
Chi E,
Grasing K,
Brecher MB. Safety, tolerability, and effect of food on the pharmacokinetics of iloperidone (HP 873), a potential atypical antipsychotic.
J Clin Pharmacol. 1995 ;35: 713-20
(7)
Subramanian N,
Kalkman HO. Receptor profile of P88-8991 and P95-12113, metabolites of the novel antipsychotic iloperidone.
Prog Neuropsychopharmacol Biol Psychiatry. 2002; 26: 553-60
(8)
Potkin SG,
Litman RE,
Torres R,
Wolfgang CD. Efficacy of iloperidone in the treatment of schizophrenia: initial phase 3 studies.
J Clin Psychopharmacol. 2008; 28:S4-11
(9)
Weiden PJ,
Cutler AJ,
Polymeropoulos MH,
Wolfgang CD.Safety profile of iloperidone: a pooled analysis of 6-week acute-phase pivotal trials..
J Clin Psychopharmacol. 2008;28:S12-19
(10)
Cutler AJ,
Kalali AH,
Weiden PJ,
Hamilton J,
Wolfgang CD. Four-week, double- blind, placebo- and ziprasidone-controlled trial of iloperidone in patients with acute exacerbations of schizophrenia.
J Clin Psychopharmacol. 2008;28:S20-8
(11)
Kane JM,
Lauriello J,
Laska E,
Di Marino M, . Long-term efficacy and safety of iloperidone: results from 3 clinical trials for the treatment of schizophrenia.
J Clin Psychopharmacol. 2008;28:S29-35